Entropy là gì? Yêu cầu cần đạt về nội dung Entropy và biến thiên năng lượng tự do Gibbs trong Hóa học lớp 10 là gì?
Entropy là gì? Yêu cầu cần đạt về nội dung Entropy và biến thiên năng lượng tự do Gibbs trong Hóa học lớp 10? Phương pháp giáo dục môn Hoá học lớp 10 được quy định như thế nào?
Entropy là gì?
(1) Entropy là gì?
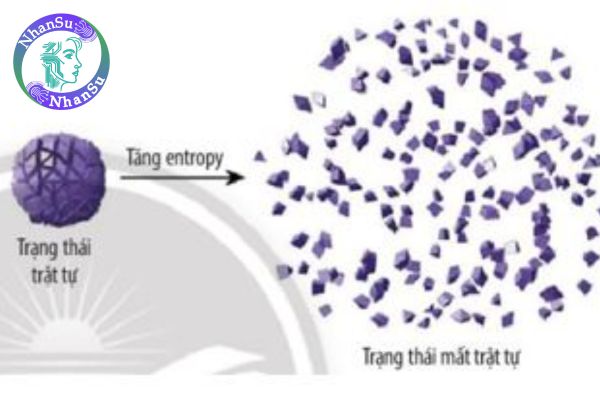
Entropy là đại lượng biểu thị mức độ hỗn loạn hay mất trật tự của một hệ thống. Một hệ có entropy cao khi các phần tử trong đó sắp xếp lộn xộn và khó kiểm soát hơn.
Entropy là một đại lượng trạng thái, nghĩa là nó chỉ phụ thuộc vào trạng thái của hệ, không phụ thuộc vào cách hệ đạt đến trạng thái đó.
Đơn vị của entropy trong hệ đo lường quốc tế là joule trên mol trên kelvin.
(2) Nguyên tắc biến thiên của Entropy
Entropy của một hệ có thể tăng hoặc giảm trong một quá trình:
Entropy tăng khi hệ chuyển sang trạng thái hỗn loạn hơn. Các trường hợp phổ biến gồm:
Chất rắn chuyển thành chất lỏng, hoặc chất lỏng chuyển thành chất khí, vì các hạt chuyển động tự do hơn.
Hòa tan một chất rắn vào nước để tạo thành dung dịch.
Một phản ứng hóa học tạo ra nhiều phân tử khí hơn so với ban đầu.
Entropy giảm khi hệ chuyển sang trạng thái có trật tự hơn. Các trường hợp phổ biến gồm:
Chất khí ngưng tụ thành chất lỏng hoặc chất rắn.
Các ion trong dung dịch kết tinh tạo thành chất rắn.
Một phản ứng tổng hợp tạo ra các phân tử phức tạp từ nhiều phân tử đơn giản.
(3) So sánh entropy của các trạng thái vật chất
Mức độ mất trật tự của các chất phụ thuộc vào trạng thái của chúng:
Entropy của chất rắn thấp nhất vì các hạt sắp xếp chặt chẽ và ít chuyển động.
Entropy của chất lỏng cao hơn chất rắn vì các hạt có thể di chuyển tự do hơn.
Entropy của chất khí cao nhất vì các hạt chuyển động hoàn toàn tự do và không theo một trật tự nào.
Ví dụ:
Entropy của nước đá thấp hơn entropy của nước lỏng.
Entropy của nước lỏng thấp hơn entropy của hơi nước.
Entropy của khí oxi cao hơn khí cacbonic vì khí oxi có cấu trúc đơn giản hơn và chuyển động hỗn loạn hơn.
(4) Mối liên hệ giữa entropy và phản ứng hóa học
Entropy ảnh hưởng đến quá trình tự xảy ra của phản ứng hóa học. Một phản ứng có thể tự xảy ra nếu tổng năng lượng tự do của hệ giảm xuống.
Nếu entropy tăng và năng lượng tự do giảm, phản ứng có thể tự xảy ra mà không cần cung cấp năng lượng từ bên ngoài.
Nếu entropy giảm, phản ứng khó tự xảy ra hơn và có thể cần thêm năng lượng.
Ở nhiệt độ cao, sự thay đổi entropy trở nên quan trọng hơn trong việc quyết định chiều hướng phản ứng.
(5) Ví dụ thực tế về Entropy trong Hóa học
Sự bay hơi của nước:
Khi nước lỏng biến thành hơi nước, entropy tăng vì các phân tử nước chuyển động tự do hơn.
Phản ứng phân hủy kali clorat:
Khi kali clorat bị phân hủy tạo ra kali clorua và khí oxi, entropy tăng vì số lượng phân tử khí tăng lên.
Hòa tan muối ăn vào nước:
Khi muối ăn tan trong nước, các ion natri và clorua phân tán trong dung dịch, làm tăng mức độ hỗn loạn và entropy tăng.
Sự ngưng tụ của hơi nước:
Khi hơi nước ngưng tụ thành nước lỏng, entropy giảm vì các phân tử nước bị kéo lại gần nhau, giảm mức độ hỗn loạn.
Lưu ý, thông tin về Entropy là gì? chỉ mang tính chất tham khảo!
Entropy là gì? Yêu cầu cần đạt về nội dung Entropy và biến thiên năng lượng tự do Gibbs trong Hóa học lớp 10 là gì? (Hình từ Internet)
Yêu cầu cần đạt về nội dung Entropy và biến thiên năng lượng tự do Gibbs trong Hóa học lớp 10 là gì?
Căn cứ theo mục 2 Mục 5 Chương trình giáo dục phổ thông môn Hóa học ban hành kèm theo Thông tư 32/2018/TT-BGDĐT có quy định về yêu cầu cần đạt về nội dung Entropy và biến thiên năng lượng tự do Gibbs trong Hóa học lớp 10 như sau:
- Nêu được khái niệm về Entropy S (đại lượng đặc trưng cho độ mất trật tự của hệ).
- Nêu được ý nghĩa của dấu và trị số của biến thiên năng lượng tự do Gibbs (không cần giải thích ΔrG là gì, chỉ cần nêu: Để xác định chiều hướng phản ứng, người ta dựa vào biến thiên năng lượng tự do ΔrG) của phản ứng (ΔG) để dự đoán hoặc giải thích chiều hướng của một phản ứng hoá học.
- Tính được ΔrGo theo công thức ΔrGo = ΔrHo - T.ΔrSo từ bảng cho sẵn các giá trị ΔfHo và So của các chất.
Phương pháp giáo dục môn Hoá học lớp 10 được quy định như thế nào?
Căn cứ theo tiểu mục 1 Mục 6 Chương trình giáo dục phổ thông môn Hóa học ban hành kèm theo Thông tư 32/2018/TT-BGDĐT có quy định phương pháp giáo dục môn Hoá học lớp 10 được thực hiện theo các định hướng chung như sau:
- Phát huy tính tích cực, chủ động, sáng tạo của học sinh; tránh áp đặt một chiều, ghi nhớ máy móc; tập trung bồi dưỡng năng lực tự chủ và tự học để học sinh có thể tiếp tục tìm hiểu, mở rộng vốn tri thức, tiếp tục phát triển các phẩm chất, năng lực sau khi tốt nghiệp trung học phổ thông.
- Rèn luyện kĩ năng vận dụng kiến thức hoá học để phát hiện và giải quyết các vấn đề trong thực tiễn; khuyến khích và tạo điều kiện cho học sinh được trải nghiệm, sáng tạo trên cơ sở tổ chức cho học sinh tham gia các hoạt động học tập, tìm tòi, khám phá, vận dụng.
- Vận dụng các phương pháp giáo dục một cách linh hoạt, sáng tạo, phù hợp với mục tiêu, nội dung giáo dục, đối tượng học sinh và điều kiện cụ thể. Tuỳ theo yêu cầu cần đạt, giáo viên có thể sử dụng phối hợp nhiều phương pháp dạy học trong một chủ đề. Các phương pháp dạy học truyền thống (thuyết trình, đàm thoại,...) được sử dụng theo hướng phát huy tính tích cực, chủ động của học sinh. Tăng cường sử dụng các phương pháp dạy học đề cao vai trò chủ thể học tập của học sinh (dạy học thực hành, dạy học dựa trên giải quyết vấn đề, dạy học dựa trên dự án, dạy học dựa trên trải nghiệm, khám phá; dạy học phân hoá,... bằng những kĩ thuật dạy học phù hợp).
- Các hình thức tổ chức dạy học được thực hiện một cách đa dạng và linh hoạt; kết hợp các hình thức học cá nhân, học nhóm, học ở lớp, học theo dự án học tập, tự học,... Đẩy mạnh ứng dụng công nghệ thông tin và truyền thông trong dạy học hoá học. Coi trọng các nguồn tư liệu ngoài sách giáo khoa và hệ thống các thiết bị dạy học được trang bị; khai thác triệt để những lợi thế của công nghệ thông tin và truyền thông trong dạy học trên các phương tiện kho tri thức - đa phương tiện, tăng cường sử dụng các tư liệu điện tử (như phim thí nghiệm, thí nghiệm ảo, thí nghiệm mô phỏng,...).
Từ khóa: Entropy là gì Biến thiên năng lượng Hóa học lớp 10 Phương pháp giáo dục Nội dung Entropy
- Nội dung nêu trên được NhanSu.vn biên soạn và chỉ mang tính chất tham khảo, không thay thế thông tin chính thức từ nhà tuyển dụng;
- Điều khoản được áp dụng (nếu có) có thể đã hết hiệu lực tại thời điểm bạn đang đọc. Quý khách vui lòng kiểm tra lại trước khi áp dụng;
- Mọi ý kiến thắc mắc về bản quyền, nội dung của bài viết vui lòng liên hệ qua địa chỉ email hotrophaply@NhanSu.vn;

 Danh sách các trường đào tạo nhân lực điện hạt nhân năm 2025?
Danh sách các trường đào tạo nhân lực điện hạt nhân năm 2025?
 Giáo viên dạy thêm thể dục thể thao cho học sinh tiểu học có được không?
Giáo viên dạy thêm thể dục thể thao cho học sinh tiểu học có được không?
 Chính thức công bố thông tin tuyển sinh trường Đại học Luật - Đại học Huế?
Chính thức công bố thông tin tuyển sinh trường Đại học Luật - Đại học Huế?
 Chính thức: Đáp án đề thi vào lớp 6 của TP Thủ Đức chính xác nhất 2025?
Chính thức: Đáp án đề thi vào lớp 6 của TP Thủ Đức chính xác nhất 2025?
 Hướng dẫn mức chi tổ chức thực hiện công tác thi đua, khen thưởng theo Thông tư 28?
Hướng dẫn mức chi tổ chức thực hiện công tác thi đua, khen thưởng theo Thông tư 28?
 Cập nhật đáp án đề thi thử toán Tiền Giang 2025 chi tiết nhất?
Cập nhật đáp án đề thi thử toán Tiền Giang 2025 chi tiết nhất?
 Cách tra cứu điểm thi tuyển sinh lớp 10 phổ thông năng khiếu TPHCM 2025?
Cách tra cứu điểm thi tuyển sinh lớp 10 phổ thông năng khiếu TPHCM 2025?
 Hướng dẫn tra cứu điểm thi tuyển sinh lớp 10 Hà Nội năm 2025 nhanh nhất? Link tra cứu điểm thi tuyển sinh lớp 10 Hà Nội?
Hướng dẫn tra cứu điểm thi tuyển sinh lớp 10 Hà Nội năm 2025 nhanh nhất? Link tra cứu điểm thi tuyển sinh lớp 10 Hà Nội?
 Cách tra cứu điểm thi tuyển sinh lớp 10 TPHCM năm 2025 nhanh nhất? Link tra cứu điểm thi tuyển sinh lớp 10 TPHCM?
Cách tra cứu điểm thi tuyển sinh lớp 10 TPHCM năm 2025 nhanh nhất? Link tra cứu điểm thi tuyển sinh lớp 10 TPHCM?
 Hướng dẫn đăng ký xét tuyển bằng học bạ online 2025 nhanh chóng nhất?
Hướng dẫn đăng ký xét tuyển bằng học bạ online 2025 nhanh chóng nhất?











