Toàn văn Công văn 1135/QLD-CL: Danh sách 21 loại thuốc giả, thuốc lưu hành trái phép trên thị trường
Tại Công văn 1135/QLD-CL, Cục Quản lý dược (Bộ Y tế) đã nêu ra danh sách 21 loại thuốc giả, thuốc lưu hành trái phép trên thị trường mà cơ sở kinh doanh thuốc cần chú ý.
Toàn văn Công văn 1135/QLD-CL: Danh sách 21 loại thuốc giả, thuốc lưu hành trái phép trên thị trường (Hình từ Internet)
Toàn văn Công văn 1135/QLD-CL: Danh sách 21 loại thuốc giả, thuốc lưu hành trái phép trên thị trường
Ngày 19/9/2025, Cục Quản lý dược (Bộ Y tế) đã có Công văn 1135/QLD-CL về việc cảnh báo thuốc giả, thuốc thuốc lưu hành trái phép trên thị trường.
Nội dung Công văn 1135/QLD-CL nêu rõ như sau:
Ngày 16/4/2025, Công an tỉnh Thanh Hóa đã triệt phá một đường dây sản xuất, buôn bán thuốc tân dược giả với quy mô lớn trên phạm vi toàn quốc, bắt giữ và khởi tố 14 bị can về tội "sản xuất, buôn bán hàng giả là thuốc phòng bệnh, thuốc chữa bệnh".
Trong số 21 sản phẩm bị thu giữ, có 04 loại được xác định là giả mạo thuốc đã được Bộ Y tế cấp phép lưu hành, gồm: Tetracyclin, Clorocid, Pharcoter và Neo-Codion; các sản phẩm còn lại không trùng khớp với bất kỳ loại thuốc nào nằm trong danh mục đãđược Bộ Y tế cấp giấy phép đăng ký lưu hành.
[1] Thông báo rộng rãi đến các cơ sở kinh doanh, cơ sở sử dụng thuốc không được kinh doanh, buôn bán, sử dụng các sản phẩm giả sau:
- Viên nénClorocid TW3 (Cloramphenicol 250mg),SĐK: VD-25305-16, Nhà sản xuất: Công ty cổ phần dược phẩm TW 3, đóng gói dạng lọ nhựa 400 viên.
- Viên nén Tetracyclin TW3 (Tetracyclin hydroclorid 250mg), SĐK: VD-28109-17, Nhà sản xuất: Công ty cổ phần dược phẩm TW 3, đóng gói dạng lọ nhựa 400 viên.
- Viên nén Pharcoter (Codein base 10mg; Terpin hydrat 100mg), Số đăng ký: VD-14429-11,Nhà sản xuất:Công ty cổ phần dược phẩm Trung ương1 (Pharbaco), đóng gói dạng lọ nhựa 400 viên.
- Sản phẩm giả thuốc Neo-Codion (Ghi chú: Thuốc Neo-Codion được Bộ Y tế cấp phép lưu hành với các thông tin chính thức như sau: Số giấy phép lưu hành: 300111082223 (SĐKcũ: VN-18966-15); Hoạt chất:Codein base (dướidạng Codein camphosulfonat 25mg) 14,93mg; Sulfogaiacol 100mg; Cao mềm Grindelia 20mg; Dạng bào chế: Viên nén bao đường; Đóng gói: Hộp 2 vỉ x 10 viên; Nhà sản xuất: Công ty Sophartex (Pháp), địa chỉ: 21, rue du Pressoir, Vernouillet, 28500).
-16 sản phẩm không thuộc danh mục thuốc đã được Bộ Y tế cấp giấy đăng ký lưu hành.
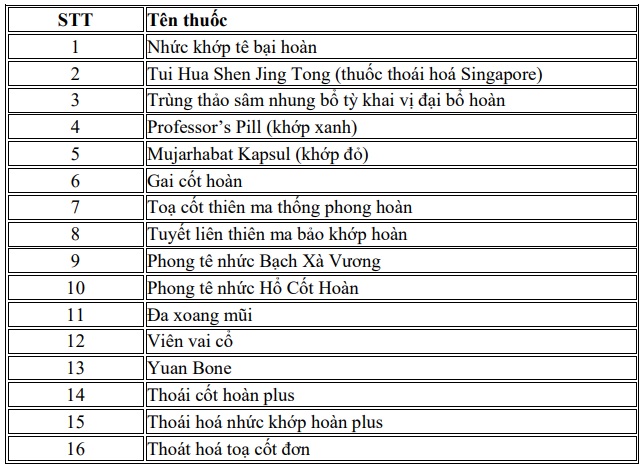
[2] Triển khai thực hiện nghiêm Công điện 41/CĐ-TTg ngày 17/4/2025 về xử lý vụ việc sản xuất, buôn bán hàng giả là thuốc chữa bệnh, thực phẩm bảo vệ sức khỏe; Chỉ thị 17/CT-TTg ngày 19/6/2018 của Thủ tướng Chính phủ về tăng cường đấu tranh chống buôn lậu, gian lận thương mại, sản xuất, kinh doanh hàng giả, hàng kém chất lượng thuộc nhóm hàng dược phẩm, mỹ phẩm, thực phẩm chức năng, dược liệu và vị thuốc y học cổ truyền;
Công văn 7173/BYT-QLD ngày 12/12/2022 của Bộ Y tế về việc tăng cường quản lý, kiểm tra chất lượng thuốc, đấu tranh chống thuốc giả, thuốc không rõ nguồn gốc xuất xứ và các chỉ đạo của Cục QLD tại các công văn 3028/QLD-CL ngày 31/3/2020, 11152/QLD-CL ngày 21/7/2020, 9097/QLD-CL và 9098/QLD-CL ngày 17/08/2023, tăng cường giám sát, kiểm tra chặt chẽ nhằm kịp thời phát hiện và xử lý nghiêm các hành vi vi phạm, đảm bảo quyền lợi và sức khỏe người tiêu dùng.
[3] Chỉ đạo các bệnh viện, cơ sở khám chữa bệnh trên địa bàn rà soát lại quy trình mua thuốc, cung ứng thuốc và tình hình cung ứng thuốc trong thời gian qua; bảo đảm thuốc được cung ứng là thuốc đã được cấp giấy phép lưu hành và cung ứng bởi các cơ sở kinh doanh dược hợp pháp, có hóa đơn chứng từ đầy đủ.
Trường hợp phát hiện thuốc có dấu hiệu nghi ngờ bấtthường, thuốc chưa được cấp phép lưu hành, lập tức niêm phong, không tiếp tục sử dụng thuốc và báo cáo cơ quan quản lý y tế, cơ quan chức năng để kiểm tra, xác minh và xử lý theo quy định của pháp luật.
Xem thêm tại Công văn 1135/QLD-CL ngày 19/4/2025.
|
Theo Luật Dược 2016, thuốc giả là thuốc được sản xuất thuộc một trong các trường hợp sau đây: - Không có dược chất, dược liệu; - Có dược chất không đúng với dược chất ghi trên nhãn hoặc theo tiêu chuẩn đã đăng ký lưu hành hoặc ghi trong giấy phép nhập khẩu; - Có dược chất, dược liệu nhưng không đúng hàm lượng, nồng độ hoặc khối lượng đã đăng ký lưu hành hoặc ghi trong giấy phép nhập khẩu, trừ thuốc không đạt tiêu chuẩn chất lượng quy định tại khoản 32 Điều 2 Luật Dược 2016 trong quá trình bảo quản, lưu thông phân phối; - Được sản xuất, trình bày hoặc dán nhãn nhằm mạo danh nhà sản xuất, nước sản xuất hoặc nước xuất xứ. |
Hành vi bị nghiêm cấm trong hoạt động kinh doanh dược năm 2025
Theo khoản 5 Điều 6 Luật Dược 2016, các hành vi bị nghiêm cấm kinh doanh dược thuộc một trong các trường hợp sau đây:
- Thuốc giả, nguyên liệu làm thuốc giả;
- Thuốc, nguyên liệu làm thuốc không đạt tiêu chuẩn chất lượng; thuốc, nguyên liệu làm thuốc đã có thông báo thu hồi của cơ quan nhà nước có thẩm quyền; thuốc, nguyên liệu làm thuốc không rõ nguồn gốc, xuất xứ; thuốc, nguyên liệu làm thuốc đã hết hạn dùng;
- Thuốc, nguyên liệu làm thuốc thuộc danh mục thuốc, nguyên liệu làm thuốc cấm nhập khẩu, cấm sản xuất;
- Thuốc thử lâm sàng;
- Thuốc, nguyên liệu làm thuốc làm mẫu để đăng ký, kiểm nghiệm, nghiên cứu khoa học, tham gia trưng bày tại triển lãm, hội chợ;
- Thuốc, nguyên liệu làm thuốc chưa được phép lưu hành;
- Thuốc thuộc chương trình mục tiêu quốc gia, thuốc viện trợ và thuốc khác có quy định không được bán;
- Bán lẻ thuốc kê đơn mà không có đơn thuốc; bán lẻ vắc xin;
- Bán thuốc cao hơn giá kê khai, giá niêm yết.
Từ khóa: Thuốc giả Thuốc lưu hành trái phép Kinh doanh dược Luật Dược Công văn 1135
- Nội dung nêu trên là phần giải đáp, tư vấn của chúng tôi dành cho khách hàng của NhanSu.vn, chỉ mang tính chất tham khảo;
- Điều khoản được áp dụng (nếu có) có thể đã hết hiệu lực tại thời điểm bạn đang đọc. Quý khách vui lòng kiểm tra lại thông tin trước khi áp dụng;
- Mọi ý kiến thắc mắc về bản quyền, nội dung của bài viết vui lòng liên hệ qua địa chỉ email hotrophaply@NhanSu.vn;

































 Đăng xuất
Đăng xuất
 Việc làm Hồ Chí Minh
Việc làm Hồ Chí Minh















